今回は、シャペロンについてまとめていきましょう。
ちょっと耳慣れない分野ですが、タンパク質の構造を考えるうえでは重要な内容です。少し難しめですが、頑張って読んでみてください!
タンパク質の折り畳み
さて、タンパク質はアミノ酸がペプチド結合したポリペプチド鎖から成るわけですが、そのままではタンパク質としての機能を発揮することはできません。タンパク質が機能を発揮するためには、タンパク質が正しく折り畳まれて正常な立体構造を形成することが必要です。このことをタンパク質のフォールディングとも呼びます。
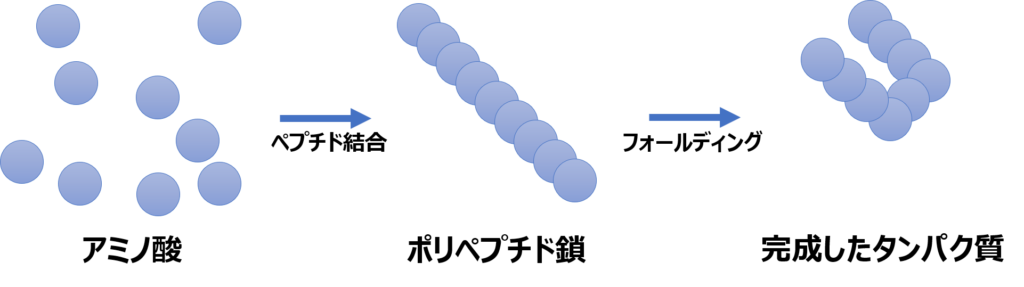
さて、1950年代ごろ、「タンパク質の立体構造はアミノ酸配列さえ決まれば自動的に折り畳まれる」と考えられてきました。言い換えると、「タンパク質はエネルギーが最小の状態に勝手に折り畳まれる」ということです。
この事実は試験管内では証明され、細胞内でも同様の折り畳みが起こると考えられてきました。しかし、そう簡単ではなかったのです。
フォールディングと凝集体形成
フォールディングは、ポリペプチド鎖内の疎水的なアミノ酸同士が結合することにより完成します。これは、疎水的なもの同士が集まろうとする「疎水相互作用」という性質によるものです。
しかし、細胞内ではポリペプチド同士が密集している状態です。そのような状況では、ポリペプチド鎖同士が疎水性のアミノ酸を介してくっつこうとしてしまいます。
通常、タンパク質の凝集体形成は不可逆的な反応です。そのため、ポリペプチド鎖同士が凝集してしまうと、せっかく合成したポリペプチド鎖がゴミになってしまいます。
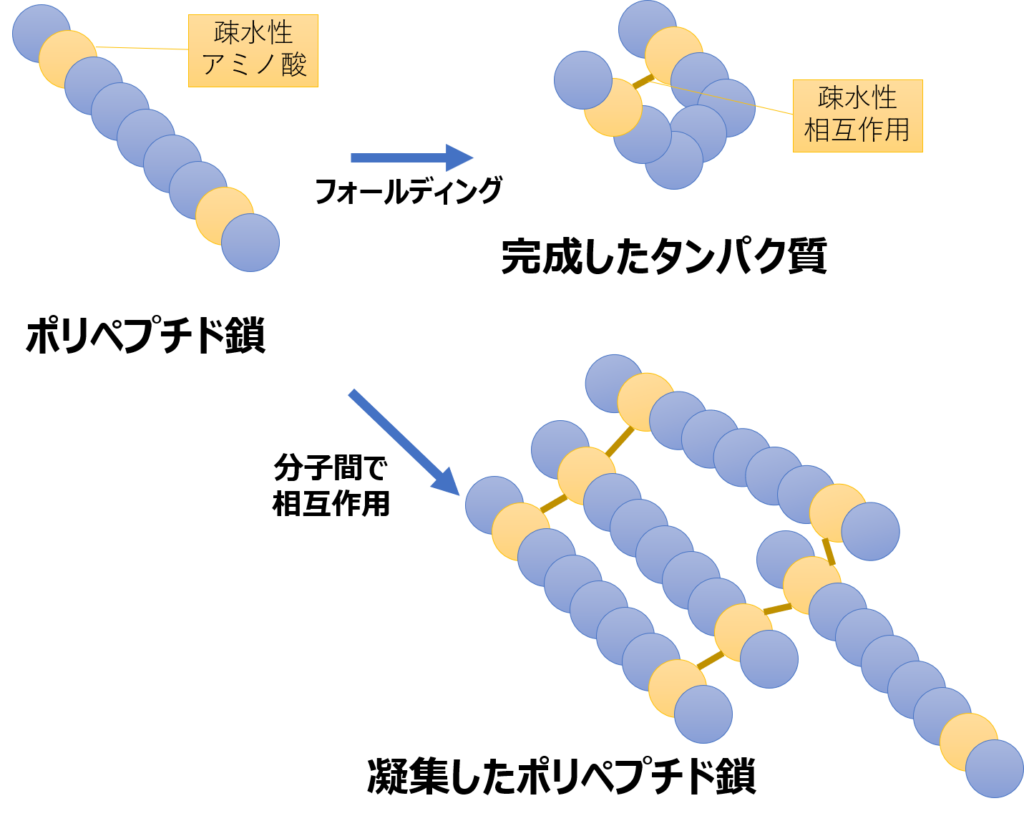
また、間違ったフォールディングをしてしまうのも問題です。フォールディングに失敗したタンパク質は凝集して有害なものになってしまうケースが多いのです。BSE(牛海綿状脳症)の原因であるプリオンタンパク質や、アルツハイマー病の原因となるβアミロイドタンパク質は、間違ったフォールディングの結果できてしまったタンパク質です。
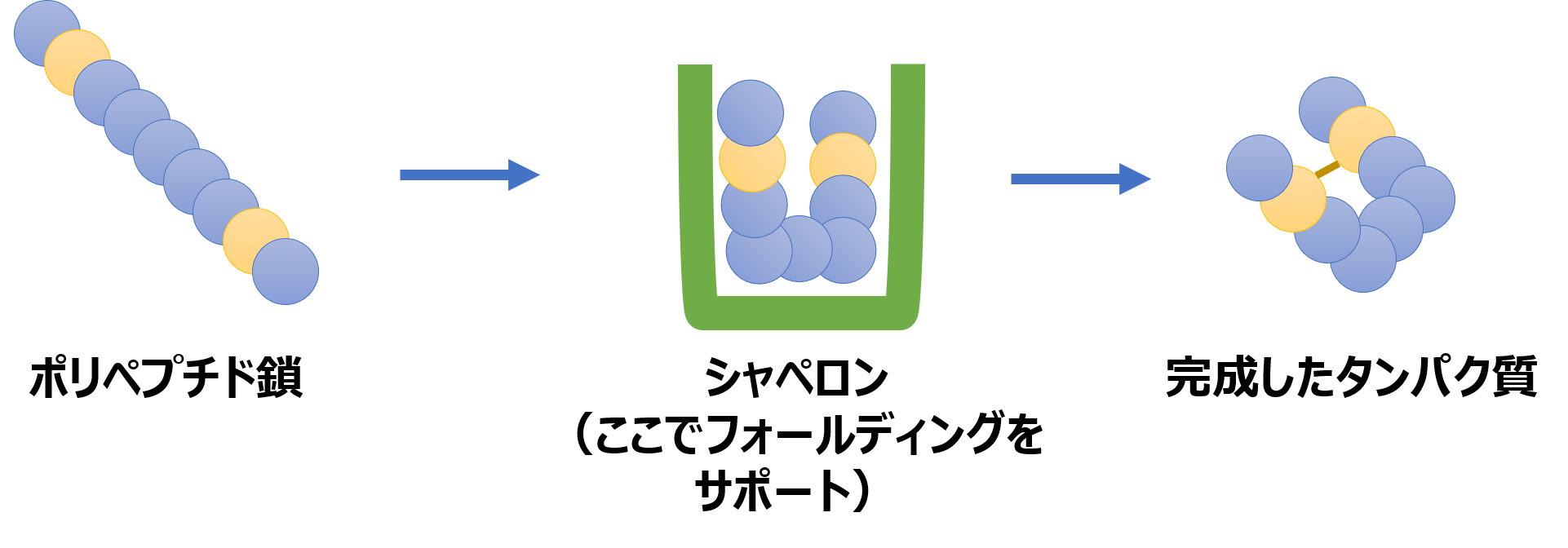
そこで、様々な物質で込み合った細胞内で、ポリペプチド鎖が適切にフォールディングできるようにサポートする役割を果たすのがシャペロンです(分子シャペロンとも言います)。
シャペロンの機能
シャペロンは、折り畳まれていない、もしくは折り畳みに失敗したポリペプチド鎖を適切に折り畳んで、機能をもつタンパク質に仕上げるのを助ける物質です。シャペロン自身もタンパク質でできています。
シャペロン自身の構造は反応前後で変化しないですし、シャペロンは対象とするポリペプチド鎖の折り畳みを助けた後は、ポリペプチド鎖と離れてまた他のポリペプチド鎖を助けます。こう言った特性は、酵素に近いものがあります。
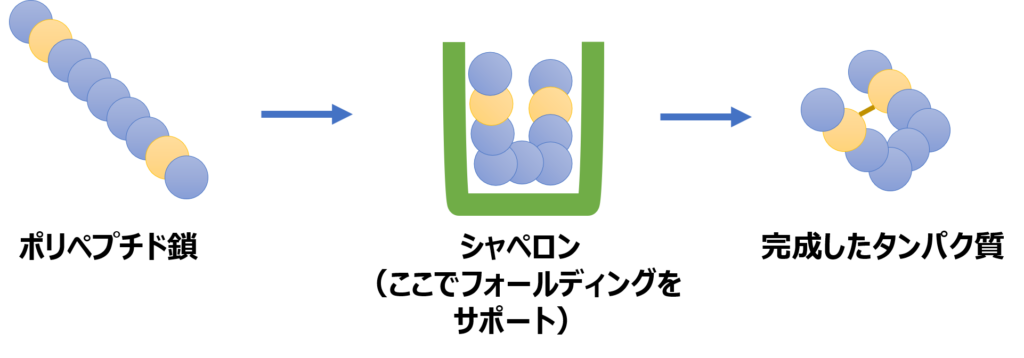
シャペロンの機能はフォールディングの補助だけではなく、熱変性したタンパク質の再生、タンパク質の輸送、複合体形成、凝集したポリペプチド鎖の解除など様々です。
熱ショックタンパク質
シャペロンにはいくつかの種類がありますが、多くのシャペロンは熱ショックタンパク質(HSP)と呼ばれるタイプです。これは、温度の上昇によるタンパク質の損傷を抑制するためのもので、タンパク質が高熱にさらされて熱変性した際に、そのタンパク質のフォールディングが元通りになるように制御する、というものです。
細胞が熱ショックを受けると、この熱ショックタンパク質の合成が活性化され、損傷を受けたタンパク質を回復させるように働くことが分かっています。
ちなみに、この熱ショックタンパク質を活性化させることで、アルコールや紫外線などの種々のストレスから細胞を保護することが分かっています。この作用を医薬品や化粧品に応用する研究が進んでいます。
また、がん細胞の発生や増殖には、熱ショックタンパク質の一種であるHSP90やHSP70、およびその生合成に関する遺伝子が関与しているという研究結果もあり、がんの治療という観点でも注目されています。
まとめ
シャペロンと、その代表格である熱ショックタンパク質について解説しました。やや高度な内容ではありますが、タンパク質の機能を考えるうえでは非常に大切な存在です。
ちなみに、シャペロン(chaperone)の語源は、「西洋の貴族社会において、若い女性が社交界デビューをする際に礼儀やマナーを伝えるために付き添う女性」です。タンパク質が正常な働きを獲得するために、シャペロンが付き添っている、というイメージなのですね。
それでは!